Pile à combustible alcaline
Les piles à combustible alcalines est une des technologies de piles à combustible les plus développées. C'est aussi une technologie qui fut employée lors des expéditions lunaires.
Recherche sur Google Images :

Source image : www.directindustry.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Polymer membrane d'échange de la pile à combustible (PEMFC), les piles à combustible à oxyde solide (SOFC), les piles à combustible alcaline (AFC), ... (source : fr.tech-faq)
Les piles à combustible alcalines (ou AFC selon l'acronyme de l'appellation anglaise alkaline fuel cell) est une des technologies de
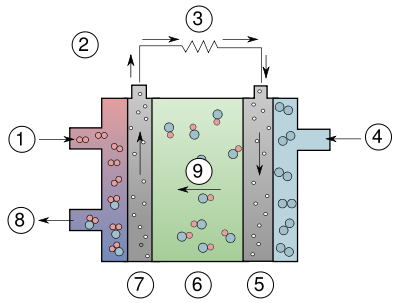
La pile à combustible produit de l'énergie grâce à une réaction d'oxydo-réduction entre l'hydrogène et l'oxygène. A l'anode, l'hydrogène est oxydé selon la réaction : 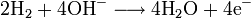
produisant de l'eau et lâchant deux électrons. Les électrons transitent par un circuit externe et retournent à la cathode, où ils diminuent l'oxygène selon la réaction : 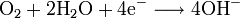
produisant des ions hydroxyde.
La réaction totale nette consomme une molécule d'oxygène (O2) et deux d'hydrogène (H2) pour produire deux molécules d'eau (H2O). De l'électricité et de la chaleur sont créés, produits secondaires de la réaction.
Les électrodes sont scindées par une matrice poreuse saturée par une solution alcaline aqueuse, comme par exemple de l'hydroxyde de potassium (KOH). Les solutions aqueuses ne rejettent pas de dioxyde de carbone (CO2) ce qui peut empoisonner aisément la pile. Pour cette raison, ce type de pile nécessite de l'oxygène pur, ou du moins de l'air purifié. Ces procédés sont assez coûteux, ce qui fait que peu de développements continus sont produits sur la technologie AFC. La NASA a d'ailleurs opté pour les piles à combustible à membrane échangeuse de protons pour la prochaine génération de navettes spatiales.
Les AFC restent cependant les moins chères des piles à combustible à produire. Le catalyseur requis pour les électrodes peuvent être choisis parmi de nombreux produits chimiques assez peu coûteux comparés à ceux requis pour d'autres types de piles à combustible.
Voir aussi
Liens externes
- (en) Astris Energi Inc
- (en) Cenergie Corporation plc - remarquer : [1] et [2]
- (en) Independent Power
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Alkaline fuel cell».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 29/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité